Сколько же всего генов у человека? ДНК-рекордсмены: как соотносятся между собой геномы человека и червяка Сколько всего генов в организме человека
Статья на конкурс «био/мол/текст»: Это интересный вопрос, ответ на который должен был дать проект «Геном человека», завершившийся в 2003 году. После того как ученые получили основную информацию о геноме человека, они попытались определить число генов, но эта задача оказалось не такой простой. Цель настоящей статьи - суммировать и проанализировать научные данные по составлению каталога генов у человека.
Генеральный спонсор конкурса - компания «Диаэм» : крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр .

«Книжный» спонсор конкурса - «Альпина нон-фикшн »
Как же мало известно о генах! Первый раз я остро ощутила это, находясь на практике в лаборатории медицинской генетики Харбинского медицинского университета. Исследовательская группа, где я проходила стажировку, занималась изучением онкогена Sei-1, который индуцирует образование двухминутных хромосом (DM), что способствует развитию онкогенеза. Однако механизм образования онкогена Sei-1 остается неизвестным до сих пор. А ведь различные мутации генов являются причиной возникновения и других опасных заболеваний человека, помимо рака. Итак, в данной статье мы изложим некоторые соображения о том, почему мы все еще многое не знаем о генах, а также сформулируем наше мнение о том, сколько генов у человека.
Проект «Геном человека» и полный список генов
Выявление полного списка генов необходимо для выяснения молекулярных механизмов возникновения и развития рака, шизофрении , деменции , а также многих других заболеваний человека. Секвенирование ДНК, выделенной из тканей больных, позволяет выявлять такие мутации, как нуклеотидные замены, делеции и вставки, ответственные за возникновение этих заболеваний.
Собственно, ради этого и затевался проект «Геном человека» (Human genome project, HGP ), который продолжался с 1990 по 2003 год. Его основной задачей было определение нуклеотидной последовательности ДНК человека и локализации 100 000 человеческих генов (как тогда полагали) . Параллельно с этим планировалось изучить ДНК набора модельных организмов, чтобы получить сравнительную информацию, необходимую для понимания функционирования генома человека. Предполагалось, что информация, полученная в результате HGP, станет настольной книгой для биомедицинской науки в XXI веке . Целями данных исследований являлось получение информации о причинах ряда болезней и, в конечном итоге, разработка способов лечения более чем 4000 генетических заболеваний, которые затрагивают человечество, включая многофакторные, в которых генетическая предрасположенность играет важную роль. Считалось, что результаты секвенирования генома позволят определить локализацию каждого гена и их общее количество. Однако последовавшие за этим события доказали обратное: сегодня существует несколько баз данных генов, которые существенно отличаются друг от друга. Причем число белок-кодирующих генов совпадает, а число генов других типов расходится.
Проект «Протеом человека»
В 2010 году по инициативе Организации по изучению протеома человека (Human proteome organization , HUPO ) был начат проект «Протеом человека » (HPP ), целью которого является создание полного списка белков вида Homo sapiens . Для этого, во-первых, предполагается идентифицировать и охарактеризовать, по крайней мере, по одному белковому продукту белок-кодирующих генов, их однонуклеотидные полиморфизмы и варианты сплайсинга, а также виды посттрансляционной модификации белков . Во-вторых, данные протеомики, полученные в результате реализации HPP, способствуют, в дополнение к геномным данным, решению различных биомедицинских задач и созданию новых аннотированных баз знаний, таких как neXtProt .
В настоящее время neXtProt содержит информацию о 17 487 белках, существование которых экспериментально подтверждено, 1728 белках, подтвержденных на уровне транскриптов, 515-и, определенных на основании гомологии, 76-и предсказанных и 571-м неизвестной природы. Особый интерес вызывают белки, существование которых экспериментально не доказано, хотя данные о том, что они кодируются геномом, существуют. Это так называемые «потерянные» белки, которые составляют примерно 18% всех кодируемых белков. Для выявления и характеристики таких белков создан ресурс MissingProteinPedia .
«Протеом человека» является продолжением проекта «Геном человека». Предполагается, что благодаря проекту по изучению протеома мы узнаем точное количество белок-кодирующих генов, что впоследствии позволит понять, сколько всего генов у человека.
Немного о РНК
Проект «Геном человека» показал, что молекулы РНК также важны для жизни, как и ДНК. Внутри клеток существует множество РНК (рис. 2). Изначально РНК подразделяются на некодирующие РНК (нкРНК ), которые не транслируются в белки, и кодирующие РНК (мРНК ), служащие матрицей для синтеза полипептидных цепей белка. Некодирующие РНК имеют более сложную классификацию. Они бывают инфраструктурными и регуляторными. Инфраструктурные РНК представлены рибосомными РНК (рРНК) и транспортными РНК (тРНК). Молекулы рРНК синтезируются в ядрышке и составляют основу рибосомы, а также кодируют белки субъединиц рибосомы. После того, как рРНК полностью собраны, они переходят в цитоплазму, где в качестве ключевых регуляторов трансляции, участвуют в чтении кода мРНК. Последовательность из трех азотистых оснований в мРНК указывает на включение определенной аминокислоты в последовательность белка. Молекулы тРНК, приносят указанные аминокислоты на рибосомы, где синтезируется белок.
Дополнительно о РНК читайте в статьях «Биомолекулы»: «Обо всех РНК на свете, больших и малых », «Кодирующие некодирующие РНК » и «Власть колец: всемогущие кольцевые РНК » .

Рисунок 2. Виды РНК
Регуляторные нкРНК очень широко представлены в организме, классифицируются в зависимости от размера и выполняют ряд важных функций (табл. 1).
| Название | Обозначение | Длина | Функции | |
|---|---|---|---|---|
| Длинные некодирующие РНК | днкРНК, lncRNA | 200 нуклеотидов | 1. Регулируют избирательное метилирование ДНК, направляя ДНК-метилтрансферазу 2. Руководят избирательной посадкой репрессорных комплексов polycomb |
|
| Малые РНК | Малые ядерные РНК | мяРНК, snRNA | 150 нуклеотидов | 1. Участвуют в сплайсинге 2. Регулируют активность факторов транскрипции 3. Поддерживают целостность теломер |
| Малые ядрышковые РНК | мякРНК, snoRNA | 60–300 нуклеотидов | 1. Участвуют в химической модификации рРНК, тРНК и мяРНК 2. Возможно, участвуют в стабилизации структуры рРНК и защите от действия гидролаз |
|
| Малые интерферирующие РНК | миРНК, siRNA | 21–22 нуклеотидов | 1. Осуществляют антивирусную иммунную защиту 2. Подавляют активность собственных генов |
|
| Микро-РНК | мкРНК, miRNA | 18–25 нуклеотидов | Подавляют трансляцию путем РНК-интерференции | |
| Антисмысловые РНК | asRNA | 1. Короткие: менее 200 нуклеотидов 2. Длинные: более 200 нуклеотидов |
Блокируют трансляцию, образуя гибриды с мРНК | |
| РНК, связанные с белками Piwi | piRNA, piwiRNA | 26–32 нуклеотидов | Их также называют «стражами генома», они подавляют активность мобильных генетических элементов во время эмбриогенеза | |
Проблема терминологии
Прежде чем ответить на вопрос: «Сколько у нас генов?», нужно понять, что же такое ген?
Основное внимание HGP было направлено на белок-кодирующие гены . Однако, как было указано в первоначальном докладе HGP в 2001 году, «тысячи генов человека продуцируют некодирующие РНК (нкРНК), являющиеся их конечным продуктом », хотя на тот момент было известно около 706 генов нкРНК . В своей недавней статье, опубликованной в журнале BMC Biology Стивен Зальцберг (Steven L. Salzberg ) дает следующее определение гена :
Ген любой участок хромосомной ДНК, который транскрибируется в функциональную молекулу РНК или сначала транскрибируется в РНК, а затем транслируется в функциональный белок.
Это определение включает как гены некодирующих РНК, так и белок-кодирующие гены, и позволяет определять все варианты альтернативного сплайсинга в одном локусе как варианты одного и того же гена. Это позволяет исключить псевдогены – нефункциональные остатки структурных генов, утратившие способность кодировать белок.
Результаты двух первых исследований свидетельствовали о наличии у человека 31 000 и 26 588 белок-кодирующих генов , а в 2004 появилась полная последовательность генома человека , и авторы подсчитали, что полный каталог насчитывает 24 000 белок-кодирующих генов. Каталог человеческих генов Ensembl включает 22 287 белок-кодирующих генов и 34 214 транскриптов .
Секвенирование нового поколения (NGS)
Появление высокопроизводительных методов параллельного секвенирования (в ходе такого секвенирования миллионы фрагментов ДНК из одного образца секвенируются одновременно) или секвенирования нового (следующего) поколения (next-generation sequencing, NGS ) позволило значительно ускорить поиск функциональных участков генома . Биотехнологические компании разработали и коммерциализировали различные платформы для NG-секвенирования, позволяющие секвенировать от 1 млн до десятков млрд коротких последовательностей (ридов, reads ) длиной 50–600 нуклеотидов каждая. К наиболее популярным платформам относятся такие, как Illumina и IonTorrent , использующие амплификацию ДНК с помощью ПЦР , а также платформы одномолекулярного секвенирования, такие как Helicos Biosciences HeliScope , Pacific Biosciences SMRT (single molecule real-time sequencing ), и нанопорового секвенирования Oxford Nanopore , осуществляющие секвенирование в реальном времени и позволяющие прочитывать значительно более длинные риды - до 10–60 тыс. нуклеотидов. Кроме того, изобретение секвенирования РНК (RNA-seq ) в 2008 году, которое создавалось для количественного определения экспрессии генов, также способствовало обнаружению транскрибируемых последовательностей, как кодирующих, так и некодирующих РНК .
Благодаря NGS, базы данных днкРНК и других генов РНК (таких как микро-РНК) резко выросли за десятилетие, и текущие каталоги генов человека теперь содержат больше генов, кодирующих РНК, чем белки (табл. 2).
| Типы генов | Gencode | Ensembl | RefSeq | CHESS |
|---|---|---|---|---|
| Белок-кодирующие гены | 19 901 | 20 376 | 20 345 | 21 306 |
| Гены длинных некодирующих РНК | 15 779 | 14 720 | 17 712 | 18 484 |
| Антисмысловые РНК | 5501 | - | 28 | 2694 |
| Другие некодирующие РНК | 2213 | 2222 | 13 899 | 4347 |
| Псевдогены | 14 723 | 1740 | 15 952 | - |
| Общее число транскриптов | 203 835 | 203 903 | 154 484 | 323 827 |
В ходе секвенирования РНК обнаружилось, что альтернативный сплайсинг, альтернативное инициирование транскрипции и альтернативное прерывание транскрипции проиcходят гораздо чаще, чем полагали, затрагивая до 95% человеческих генов. Следовательно, даже если известно местоположение всех генов, сначала нужно выявить все изоформы этих генов, а также определить, выполняют ли эти изоформы какие-либо функции или они просто представляют собой ошибки сплайсинга.
Базы данных генов человека
Задача по составлению каталога всех генов по-прежнему не решена. Проблема заключается в том, что за последние 15 лет только две исследовательские группы составили список доминантных генов: RefSeq , которая поддерживается Национальным центром биотехнологической информации (NCBI ) при Национальных институтах здоровья (NIH ), и Ensembl/Gencode , которая поддерживается Европейской молекулярно-биологической лабораторией (EMBL ). Однако, несмотря на большой прогресс, сейчас в каталогах различается количество белок-колирующих генов, генов длинных некодирующих РНК, псевдогенов, а также варьирует количество антисмысловых РНК и других некодирующих РНК (табл. 2). Каталоги еще дорабатываются: например, в прошлом году сотни генов, кодирующих белок, были добавлены или удалены из списка Gencode . Эти разногласия объясняют проблему создания полного каталога человеческих генов.
В 2017 году была создана новая база данных генов человека - CHESS . Примечательно, что она включает все белок-кодирующие гены как Gencode , так и RefSeq , так что пользователям CHESS не нужно решать, какую базу данных они предпочитают. Бóльшее количество генов может вызывать больше ошибок, но создатели считают, что бóльший набор окажется полезным при исследовании болезней человека, которые еще не отнесены к генетическим. Набор генов CHESS в настоящее время в версии 2.0 еще не окончательный, и, безусловно, создатели работают над его усовершенствованием.
Это было семь лет назад - 26-го июня 2000 года. На совместной пресс-конференции с участием президента США и премьер-министра Великобритании представители двух исследовательских групп - International Human Genome Sequencing Consortium (IHGSC) и Celera Genomics - объявили о том, что работы по расшифровке генома человека, начавшиеся ещё в 70-х годах, успешно завершены, и черновой его вариант составлен. Начался новый эпизод развития человечества - постгеномная эра.
Что может дать нам расшифровка генома, и стоят ли потраченные средства и усилия достигнутого результата? Фрэнсис Коллинз (Francis S. Collins ), руководитель американской программы «Геном человека», в 2000 году дал следующий прогноз развития медицины и биологии в постгеномную эру:
- 2010 год - генетическое тестирование, профилактические меры, снижающие риск заболеваний, и генная терапия до 25 наследственных заболеваний. Медсёстры начинают выполнять медико-генетические процедуры. Широко доступна преимплантационная диагностика, активно обсуждаются ограничения в применении данного метода. В США приняты законы для предотвращения генетической дискриминации и соблюдения конфиденциальности. Практические приложения геномики доступны не всем, особенно это чувствуется в развивающихся странах.
- 2020 год - на рынке появляются лекарства от диабета, гипертонии и других заболеваний, разработанные на основе геномной информации. Разрабатывается терапия рака, прицельно направленная на свойства раковых клеток определенных опухолей. Фармакогеномика становится общепринятым подходом для создания многих лекарств. Изменение способа диагностики психических заболеваний, появление новых способов их лечения, изменение отношения общества к таким заболеваниям. Практические приложения геномики все еще доступны далеко не везде.
- 2030 год - определение последовательности нуклеотидов всего генома отдельного индивида станет обычной процедурой, стоимость которой менее $1000. Каталогизированы гены, участвующие в процессе старения. Проводятся клинические испытания по увеличению максимальной продолжительности жизни человека. Лабораторные эксперименты на человеческих клетках заменены экспериментами на компьютерных моделях. Активизируются массовые движения противников передовых технологий в США и других странах.
- 2040 год
- Все общепринятые меры здравоохранения основаны на геномике. Определяется предрасположенность к большинству заболеваний (ещё до рождения). Доступна эффективная профилактическая медицина с учетом особенностей индивида. Болезни определяются на ранних стадиях путем молекулярного мониторинга.
Для многих заболеваний доступна генная терапия. Замена лекарств продуктами генов, вырабатываемыми организмом при ответе на терапию. Средняя продолжительность жизни достигнет 90 лет благодаря улучшению социо-экономических условий. Проходят серьезные дебаты о возможности человека контролировать собственную эволюцию.
Неравенство в мире сохраняется, создавая напряженность на международном уровне.
Как видно из прогноза, геномная информация в недалеком будущем может стать основой лечения и профилактики множества болезней. Без информации о своих генах (а она умещается на стандарный DVD-диск) человек в будущем сможет вылечить разве что насморк у какого-нибудь целителя в джунглях. Это кажется фантастикой? Но когда-то такой же фантастикой была поголовная вакцинация от оспы или интернет (заметьте, в 70-х его еще не существовало)! В будущем генетический код ребенка будут выдавать родителям в роддоме. Теоретически, при наличии такого диска, лечение и предотвращение любых недугов отдельно взятого человека станет сущим пустяком. Профессиональный врач сможет в предельно сжатые сроки поставить диагноз, назначить эффективное лечение, и даже определить вероятность появления разных болезней в будущем. К примеру, современные генетические тесты уже позволяют точно определить степень предрасположенности женщины к раку груди. Почти наверняка, лет через 40–50 ни один уважающий себя врач без генетического кода не захочет «лечить вслепую» - подобно тому, как сегодня хирургия не может обойтись без рентгеновского снимка.
Давайте зададимся вопросом - а достоверно ли сказанное, или, может быть, в действительности всё будет наоборот? Смогут ли люди наконец победить все болезни и придут ли они ко всеобщему счастью? Увы. Начнем с того, что Земля маленькая, и счастья на всех не хватит. По правде сказать, его не хватит даже для половины населения развивающихся стран. «Счастье» предназначено в основном для государств, развитых в плане науки, в частности - наук биологических. Например методика, с помощью которой можно «прочесть» генетический код любого человека, уже давно запатентована. Это отлично отработанная автоматизированная технология - правда, дорогостоящая и очень тонкая. Хочешь, покупай лицензию, а хочешь - придумывай новую методику. Только вот денег на подобную разработку хватит далеко не у всех стран! В итоге ряд государств будет обладать медициной, существенно опережающей уровень остального мира. Естественно, в слаборазвитых странах Красным Крестом будут строиться благотворительные больницы, госпитали и геномные центры. И постепенно это приведет к тому, что генетическая информация пациентов развивающихся стран (которых большинство), сосредоточится у двух-трех держав, финансирующих эту благотворительность. Что можно сделать, имея такую информацию - даже представить трудно. Может, и ничего страшного. Однако возможен и другой исход. Битва за приоритет, сопровождавшая секвенирование генома, наглядно подтверждает важность доступности генетической информации. Давайте кратко вспомним некоторые факты из истории программы «Геном человека».
Противники расшифровки генома считали поставленную задачу нереальной, ведь ДНК человека в десятки тысяч раз длиннее молекул ДНК вирусов или плазмид. Главный аргумент против был: «проект потребует миллиарды долларов, которых недосчитаются другие области науки, поэтому геномный проект затормозит развитие науки в целом. А если все-таки деньги найдутся и геном человека будет расшифрован, то полученная в результате информация не оправдает затрат... » Однако Джеймс Уотсон, один из первооткрывателей структуры ДНК и идеолог программы тотального прочтения генетической информации, остроумно парировал: «лучше не поймать большую рыбу, чем не поймать маленькую » , . Аргумент учёного был услышан - проблему генома вынесли на обсуждение в конгресс США, и в итоге была принята национальная программа «Геном человека».
В американском городе Бетесда, что недалеко от Вашингтона, находится один из координационных центров HUGO (HUman Genome Organization ). Центр координирует научную работу по теме «Геном человека» в шести странах - Германии, Англии, Франции, Японии, Китае и США. В работу включились учёные из многих стран мира, объединенные в три команды: две межгосударственные - американская Human Genome Project и британская из Wellcome Trust Sanger Institute - и частная корпорация из штата Мериленд, включившаяся в игру чуть позже, - Celera Genomics . Кстати, это пожалуй первый случай в биологии, когда на таком высоком уровне частная фирма соревновалась с межгосударственными организациями.
Борьба происходила с использованием колоссальных средств и возможностей. Как отмечали некоторое время назад российские эксперты, Celera стояла на плечах у программы «Геном Человека», то есть использовала то, что уже было сделано в рамках глобального проекта. Действительно, Celera Genomics подключилась к программе не сначала, а когда проект уже шёл полным ходом. Однако специалисты из Celera усовершенствовали алгоритм секвенирования. Кроме того, по их заказу был построен суперкомпьютер, который позволял складывать выявляемые «кирпичики» ДНК в результирующую последовательность быстрее и точнее. Конечно, все это не давало компании Celera безоговорочного преимущества, однако считаться с ней как с полноправным участником гонки заставило.
Появление Celera Genomics резко повысило напряженность - те, кто был занят в государственных программах, почувствовали жёсткую конкуренцию. Кроме того, после создания компании остро встал вопрос об эффективности использования государственных капиталовложений. Во главе Celera стал профессор Крейг Вентер (Craig Venter ) , который имел огромный опыт научной работы по государственной программе «Геном человека». Именно он и заявил, что все публичные программы малоэффективны и что в его фирме геном секвенируют быстрее и дешевле. А тут появился ещё один фактор - спохватились крупные фармацевтические компании. Дело в том, что если вся информация о геноме окажется в открытом доступе, они лишатся интеллектуальной собственности, и нечего будет патентовать. Озабоченные этим, они вложили миллиарды долларов в Celera Genomics (с которой, вероятно, было проще договориться). Это еще более укрепило её позиции. В ответ на это коллективам межгосударственного консорциума срочно пришлось повышать эффективность работ по расшифровке генома. Сначала работа шла несогласованно, но потом были достигнуты определенные формы сосуществования - и гонка начала наращивать темп.
Финал был красивым - конкурирующие организации по взаимной договоренности одновременно объявили о завершении работ по расшифровке генома человека , . Произошло это, как мы уже писали - 26 июня 2000 года. Но разница во времени между Америкой и Англией вывела на первое место США.
Рисунок 1. «Гонка за генóм», в которой участвовали межгосударственная и частная компании, формально завершилась «ничьей»: обе группы исследователей опубликовали свои достижения практически одновременно. Руководитель частной компании Celera Genomics Крейг Вентер опубликовал свою работу в журнале Science в соавторстве с ~270 учёными, работавшими под его началом . Работа, выполненная международным консорциумом по секвенированию человеческого генома (IHGSC), опубликована в журнале Nature , и полный список авторов насчитывает около 2800 человек, работавших в почти трёх десятках центров по всему миру .
Исследования в сумме продлились 15 лет. Создание первого «чернового» варианта генома человека обошлось в 300 миллионов долларов. Однако на все исследования по этой теме, включая сравнительные анализы и решение ряда этических проблем, было выделено в сумме около трех миллиардов долларов. Celera Genomics вложила примерно столько же, правда, она истратила их всего за шесть лет. Цена колоссальная, но эта сумма ничтожна в сравнении с той выгодой, которую получит страна-разработчик от ожидаемой вскоре окончательной победы над десятками серьезных заболеваний. В начале октября 2002 года в интервью «Ассошиэйтед пресс» президент Celera Genomics Крейг Вентер заявил, что одна из его некоммерческих организаций планирует заняться изготовлением компакт-дисков, содержащих максимум информации о ДНК клиента. Предварительная стоимость такого заказа - более 700 тысяч долларов. А одному из первооткрывателей структуры ДНК - доктору Джеймсу Уотсону - уже в этом году были подарены два DVD-диска с его геномом общей стоимостью 1 млн. долларов , - как видим, цены падают. Так, вице-президент фирмы 454 Life Sciences Майкл Эгхолм (Michael Egholm ) сообщил , что в скором времени компания сможет довести цену расшифровки до 100 тыс. долларов.
Широкая известность и масштабное финансирование - палка о двух концах. С одной стороны, за счет неограниченных средств работа продвигается легко и быстро. Но с другой стороны, результат исследований должен получиться таким, каким его заказывают. К началу 2001 года в геноме человека со стопроцентной достоверностью было идентифицировано больее 20 тыс. генов. Эта цифра оказалось в три раза меньше, чем было предсказано всего за два года до этого. Вторая команда исследователей из Национального института геномных исследований США во главе с Френсисом Коллинсом независимым способом получила те же результаты - между 20 и 25 тыс. генов в геноме каждой человеческой клетки. Однако неопределенность в окончательные оценки внесли два других международных совместных научных проекта. Доктор Вильям Хезелтайн (руководитель фирмы Human Genome Studies ) настаивал , что в их банке содержится информация о 140 тыс. генов. И этой информацией он не собирается пока делиться с мировой общественностью. Его фирма вложила деньги в патенты и собирается зарабатывать на полученной информации, поскольку она относится к генам широко распространенных болезней человека. Другая группа заявила о 120 тыс. идентифицированных генов человека и также настаивала, что именно эта цифра отражает общее число генов человека.
Тут необходимо уточнить, что эти исследователи занимались расшифровкой последовательности ДНК не самого генома, а ДНК-копий информационных (называемых также матричными) РНК (иРНК или мРНК). Другими словами, исследовался не весь геном, а только та его часть, что перекодируется клеткой в мРНК и направляет синтез белков. Поскольку один ген может служить матрицей для производства нескольких различных видов мРНК (что определяется многими факторами: тип клетки, стадия развития организма и т. д.), то и суммарное число всех различных последовательностей мРНК (а это именно то, что запатентовала Human Genome Studies ) будет значительно бóльшим. Скорее всего, использовать это число для оценки количества генов в геноме просто некорректно.
Очевидно, что наспех «приватизированная» генетическая информация будет в ближайшие годы тщательно проверяться, пока точное число генов станет, наконец, общепринятым. Но настораживает тот факт, что в процессе «познания» патентуется вообще все, что только можно запатентовать. Тут даже не шкура не убитого медведя, а вообще все, что находилось в берлоге, было поделено! Кстати, на сегодня дебаты сбавили обороты, и геном человека официально насчитывает только 21667 генов (версия NCBI 35 , датированная октябрём 2005 года). Следует отметить, что пока большая часть информации всё-таки остаётся общедоступной. Сейчас существуют базы данных, в которых аккумулирована информация о структуре генома не только человека, но и геномов многих других организмов (например, EnsEMBL). Однако попытки получить исключительные права на использование каких-либо генов или последовательностей в коммерческих целях всегда были, есть сейчас и будут предприниматься впредь.
На сегодня основные цели структурной части программы уже в основном выполнены - геном человека почти полностью прочитан. Первый, «черновой» вариант последовательности, опубликованный в начале 2001 года , был далек от совершенства. В нём отсутствовало приблизительно 30% последовательности генома в целом, из них около 10% последовательности так называемого эухроматина - богатых генами и активно экспрессирующихся участков хромосом. Согласно последним подсчётам, эухроматин составляет примерно 93,5% от всего генома . Оставшиеся же 6,5% приходятся на гетерохроматин - эти участки хромосом бедны генами и содержат большое количество повторов, которые представляют серьезные трудности для ученых, пытающихся прочесть их последовательность . Более того, считается, что ДНК в гетерохроматине находится в неактивном состоянии и не экспрессируется. (Этим можно объяснить такое «невнимание» ученых к оставшимся «малым» процентам человеческого генома.) Но даже имевшиеся на 2001 год «черновые» варианты эухроматиновых последовательностей содержали большое количество разрывов, ошибок и неверно соединенных и ориентированных фрагментов. Нисколько не умаляя значения для науки и ее приложений появление этого «черновика», стоит однако отметить, что использование этой предварительной информации в крупномасштабных экспериментах по анализу генома в целом (например, при исследовании эволюции генов или общей организации генома) выявило множество неточностей и артефактов. Поэтому дальнейшая и не менее кропотливая работа, «последние вершки», была абсолютно необходима.

Рисунок 2. Слева: Автоматизированная линия подготовки образцов ДНК для секвенирования в Центре Геномных исследований института Уайтхеда. Справа: Лаборатория в , заполненная автоматами для высокопроизводительной расшифровки последовательностей ДНК.
Завершение расшифровки заняло еще несколько лет и привело почти что к удвоению стоимости всего проекта. Однако уже в 2004 г. было объявлено, что эухроматин прочитан на 99% с общей точностью одна ошибка на 100 000 пар оснований. Количество разрывов уменьшилось в 400 раз. Аккуратность и полнота прочтения стала достаточной для эффективного поиска генов, отвечающих за то или иное наследственное заболевание (например, диабет или рак груди). Практически это означает, что исследователям больше не надо заниматься трудоемким подтверждением последовательностей генов, с которыми они работают, так как можно полностью положиться на определенную и доступную каждому последовательность всего генома.
Таким образом, изначальный план проекта был значительно перевыполнен. Помогло ли это нам в понимании того, как устроен и работает наш геном? Безусловно. Авторы статьи в Nature , в которой был опубликован «окончательный» (на 2004 год) вариант генома , провели с его использованием несколько анализов, которые были бы абсолютно бессмысленны, имей они на руках только «черновую» последовательность. Оказалось, что более тысячи генов «родились» совсем недавно (по эволюционным меркам, конечно) - в процессе удвоения исходного гена и последующего независимого развития дочернего гена и гена-родителя. А чуть меньше сорока генов недавно «умерли», накопив мутации, сделавшие их совершенно неактивными. Другая статья, вышедшая в том же номере журнала Nature , прямо указывает на недостатки метода, использованного учеными из Celera . Следствием этих недостатков стали пропуски многочисленных повторов в прочитанных последовательностях ДНК и, как результат, недооценённая длина и сложность всего генома. Чтобы не повторять подобных ошибок в будущем, авторы статьи предложили использовать гибридную стратегию - комбинацию высокоэффективного подхода, использовавшегося учеными из Celera , и сравнительно медленного и трудоемкого, но и более надежного метода, применявшегося исследователями из IHGSC.
Куда дальше будет направлено беспрецедентное исследование «Геном человека»? Кое-что об этом можно сказать уже сейчас. Основанный в сентябре 2003 года международный консорциум ENCODE (ENCyclopaedia Of DNA Elements ) поставил своей целью обнаружение и изучение «управляющих элементов» (последовательностей) в геноме человека. Действительно, ведь 3 млрд. пар оснований (а именно такова длина генома человека) содержат всего лишь 22 тыс. генов, разбросанных в этом океане ДНК непонятным для нас образом. Что управляет их экспрессией? Зачем нам такой избыток ДНК? Действительно ли он является балластом, или же все-таки проявляет себя, обладая какими-то неизвестными функциями ?
Для начала, в качестве пилотного проекта, ученые из ENCODE «пристально вгляделись» в последовательность, составляющую 1% от генома человека (30 млн. пар оснований), используя новейшее оборудование для исследований в молекулярной биологии. Результаты были опубликованы в апреле нынешнего года в Nature . Оказалось, что бóльшая часть генома человека (в том числе участки, считавшиеся ранее «молчащими») служит матрицей для производства различных РНК, многие из которых не являются информационными, поскольку не кодируют белков. Многие из этих «некодирующих» РНК перекрываются с «классическими» генами (участками ДНК, кодирующими белки). Неожиданным результатом было и то, как регуляторные участки ДНК были расположены относительно генов, экспрессией которых они управляли. Последовательности многих из этих участков мало изменялись в процессе эволюции, в то время как другие участки, считавшиеся важными для управления клеткой, мутировали и изменялись в процессе эволюции с неожиданно высокой скоростью . Все эти находки поставили большое количество новых вопросов, ответы на которые можно получить лишь в дальнейших исследованиях.
Другая задача, решение которой станет делом недалекого будущего, - определение последовательности оставшихся «малых» процентов генома, составляющих гетерохроматин, т. е. бедных генами и богатых повторами участков ДНК, необходимых для удвоения хромосом в процессе деления клетки. Наличие повторов делает задачу расшифровки этих последовательностей неразрешимой для существующих подходов, и, следовательно, требует изобретения новых методов. Поэтому не удивляйтесь, когда году в 2010 выйдет очередная статья, объявляющая об «окончании» расшифровки генома человека - в ней будет рассказано о том, как был «взломан» гетерохроматин.
Конечно, сейчас в нашем распоряжении имеется лишь некий «усредненный» вариант человеческого генома. Образно говоря - мы сегодня имеем лишь самое общее описание конструкции автомобиля: мотор, ходовая часть, колёса, руль, сиденья, краска, обивка, бензин с маслом и т. д. Ближайшее рассмотрение полученного результата свидетельствует о том, что впереди - годы работ по уточнению наших знаний по каждому конкретному геному. Программа «Геном человека» не прекратила свое существование, она лишь меняет ориентацию: от структурной геномики осуществляется переход к геномике функциональной, предназначенной установить, как управляются и работают гены. Более того, все люди на уровне генов отличаются так же, как одни и те же модели автомобилей отличаются различными вариантами исполнения одних и тех же агрегатов. Не только отдельные основания в последовательностях генов двух разных людей могут отличаться, но и количество копий крупных фрагментов ДНК, порой включающих в себя несколько генов, может сильно варьировать. А это означает, что на передний план выходят работы по детальному сравнению геномов, скажем, представителей различных человеческих популяций, этнических групп, и даже здоровых и больных людей. Современные технологии позволяют быстро и точно проводить такие сравнительные анализы, а ведь еще лет десять назад об этом никто и не мечтал. Изучением структурных вариаций человеческого генома занимается очередное международное научное объединение . В США и Европе значительные средства выделяются на финансирование биоинформатики - молодой науки, возникшей на стыке информатики, математики и биологии, без которой никак не разобраться в безграничном океане информации, накопленном в современной биологии. Биоинформационные методы помогут нам ответить на многие интереснейшие вопросы - «как происходила эволюция человека?», «какие гены определяют те или иные особенности человеческого организма?», «какие гены ответственны за предрасположенность к болезням?» Знаете, как говорят англичане: “This is the end of the beginning ” - «Это конец начала». Вот именно эта фраза точно отражает нынешнюю ситуацию . Начинается самое главное и - я совершенно уверен - самое интересное: накопление результатов, их сравнение и дальнейший анализ.
«...Сегодня мы выпускаем в свет первое издание „Книги жизни“ с нашими инструкциями , - сказал в эфире телеканала «Россия» Фрэнсис Коллинз. - Мы будем обращаться к нему десятки, сотни лет. И уже скоро люди зададутся вопросом, как они могли обходиться без этой информации ».
Другую точку зрения можно проиллюстрировать, процитировав академика Кордюма В. А.:
«...Надежды же на то, что новая информация о функциях генома будет полностью открытой, чисто символические. Можно прогнозировать, что возникнут (на базе уже имеющихся) гигантские центры, которые смогут все данные соединить в одно связное целое, некую электронную версию Человека и реализовывать её практически - в гены, белки, клетки, ткани, органы и что угодно ещё. Но во что? Угодное кому? Для чего? В процессе работ по программе „геном человека“ стремительно совершенствовались методы и аппаратура для определения первичной последовательности ДНК. В крупнейших центрах это превратилось в некое подобие заводской деятельности. Но даже на уровне лабораторных индивидуальных приборов (вернее их комплексов) уже создано столь совершенное оборудование, что оно способно определить за три месяца такую по объему последовательность ДНК, которая равна всему геному человека. Не удивительно, что возникла (и тут же начала стремительно реализоваться) идея определения геномов индивидуальных людей. Безусловно, это очень интересно - сравнить отличия разных индивидуумов на уровне их первоосновы. Польза от такого сравнения тоже несомненная. Можно будет установить, у кого имеются какие нарушения в геноме, прогнозировать их последствия и устранить то, что может привести к болезням. Здоровье будет гарантированным, да и жизнь продлится весьма существенно. Это с одной стороны. С другой же стороны всё совсем не очевидно. Получить и проанализировать всю наследственность индивидуума означает получение полного, исчерпывающего биологического досье на него. Оно, при желании того, кто его знает, позволит столь же исчерпывающе делать с человеком всё что угодно. По уже известной цепочке: клетка - молекулярная машина; человек состоит из клеток; клетка во всех своих проявлениях и во всём диапазоне возможных ответов, записана в геноме; с геномом можно ограниченно уже и сегодня манипулировать, а в обозримом будущем вообще манипулировать практически как угодно... »
Однако, наверное, пугаться таких мрачных прогнозов еще рано (хотя знать о них, безусловно, нужно). Для их осуществления надо полностью перестраивать многие социальные и культурные традиции. Очень хорошо по этому поводу сказал в интервью доктор биологических наук Михаил Гельфанд, и. о. заместителя директора Института проблем передачи информации РАН: «...если у вас есть, предположим, один из пяти генов, предопределяющих развитие шизофрении, то что может случиться, если эта информация - ваш геном - попала в руки вашего потенциального работодателя, который ничего в геномике не понимает! (и как следствие - вас на работу могут не принять, посчитав это рискованным; и это не смотря на то, что шизофрении у вас нет и не будет - прим. автора.) Другой аспект: с появлением индивидуализированной медицины, основанной на геномике, полностью изменится страховая медицина. Ведь одно дело - предусматривать риски неизвестные, а другое дело - совершенно определенные. Если честно, то все западное общество в целом, не только российское, к геномной революции сейчас не готово...» .
Действительно, чтобы разумно пользоваться новой информацией, надо ее понимать. А для того чтобы понять геном - не просто прочитать, этого далеко не достаточно, - нам потребуются десятилетия. Слишком уж сложная картина вырисовывается, и чтобы осознать её, нам надо будет поменять многие стереотипы. Поэтому на самом деле расшифровка генома ещё продолжается и будет продолжаться. И будем ли мы стоять в стороне или станем, наконец, активными участниками этой гонки - зависит от нас.
Литература
- Киселёв Л. (2001). Новая биология началась в феврале 2001 года . «Наука и Жизнь» ;
- Киселёв Л. (2002). Вторая жизнь генома: от структуры к функции . «Знание–Сила» . 7 ;
- Ewan Birney, The ENCODE Project Consortium, John A. Stamatoyannopoulos, Anindya Dutta, Roderic Guigó, et. al.. (2007). Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project . Nature . 447 , 799-816;
- Lincoln D. Stein. (2004). Human genome: End of the beginning . Nature . 431 , 915-916;
- Гельфанд М. (2007). Постгеномная эра . «Коммерческая биотехнология» .
"хромосома" - слова, которые знакомы каждому школьнику. Но представление об этом вопросе довольно обобщенное, так как для углубления в биохимические дебри требуются специальные знания и желание все это понимать. А оно, если и присутствует на уровне любопытства, то быстро пропадает под тяжестью изложения материала. Попробуем разобраться в хитросплетениях в научно-полярной форме.
Ген - это наименьшая структурная и функциональная частица информации о наследственности у живых организмов. По сути он представляет собой небольшой участок ДНК, в котором содержится знание об определенной последовательности аминокислот для построения белка либо функциональной РНК (с которой также будет синтезирован белок). Ген определяет те признаки, которые будут наследоваться и передаваться потомками дальше по генеалогической цепи. У некоторых одноклеточных организмов существует перенос генов, который не имеет отношения к воспроизведению себе подобных, он называется горизонтальным.
"На плечах" генов лежит огромная ответственность за то, как будет выглядеть и работать каждая клетка и организм в целом. Они управляют нашей жизнью от момента зачатия до самого последнего вздоха.

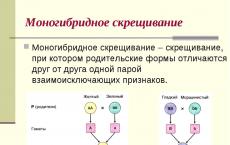
Первый научный шаг вперед в изучении наследственности был сделан австрийским монахом Грегором Менделем, который в 1866 году опубликовал свои наблюдения о результатах при скрещивании гороха. Наследственный материал, который он использовал, четко показывал закономерности передачи признаков, таких как цвет и форма горошин, а также цветки. Этот монах сформулировал законы, которые сформировали начало генетики как науки. Наследование генов происходит потому, что родители отдают своему чаду по половинке всех своих хромосом. Таким образом, признаки мамы и папы, смешиваясь, образуют новую комбинацию уже имеющихся признаков. К счастью, вариантов больше, чем живых существ на планете, и невозможно отыскать двух абсолютно идентичных существ.
Мендель показал, что наследст-венные задатки не смешиваются, а передаются от родителей потомкам в виде дискретных (обособлен-ных) единиц. Эти единицы, представленные у особей парами (аллелями), остаются дискретными и передаются по-следующим поколениям в мужских и женских га-метах, каждая из которых содержит по одной едини-це из каждой пары. В 1909 году датский ботаник Иогансен назвал эти единицы генами. В 1912 году генетик из Соединенных Штатов Америки Морган показал, что они находятся в хромосомах.
С тех пор прошло больше полутора веков, и исследования продвинулись дальше, чем Мендель мог себе представить. На данный момент ученые остановились на мнении, что информация, находящаяся в генах, определяет рост, развитие и функции живых организмов. А может быть, даже и их смерть.
Классификация
Структура гена содержит в себе не только информацию о белке, но и указания, когда и как ее считывать, а также пустые участки, необходимые для разделения информации о разных белках и остановки синтеза информационной молекулы.
Существует две формы генов:
- Структурные - они содержат в себе информацию о строении белков или цепей РНК. Последовательность нуклеотидов соответствует расположению аминокислот.
- Функциональные гены отвечают за правильную структуру всех остальных участков ДНК, за синхронность и последовательность ее считывания.
На сегодняшний день ученые могут ответить на вопрос: сколько генов в хромосоме? Ответ вас удивит: около трех миллиардов пар. И это только в одной из двадцати трех. Геном называется наименьшая структурная единица, но она способна изменить жизнь человека.
Мутации

Случайное или целенаправленное изменение последовательности нуклеотидов, входящих в цепь ДНК, называется мутацией. Она может практически не влиять на структуру белка, а может полностью извратить его свойства. А значит, будут локальные или глобальные последствия такого изменения.
Сами по себе мутации могут быть патогенными, то есть проявляться в виде заболеваний, либо летальными, не позволяющими организму развиваться до жизнеспособного состояния. Но большинство изменений проходит незаметно для человека. Делеции и дупликации постоянно совершаются внутри ДНК, но не влияют на ход жизни каждого отдельного индивидуума.
Делеция - это потеря участка хромосомы, который содержит определенную информацию. Иногда такие изменения оказываются полезными для организма. Они помогают ему защититься от внешней агрессии, например вируса иммунодефицита человека и бактерии чумы.
Дупликация - это удвоение участка хромосомы, а значит, и совокупность генов, которые он содержит, также удваивается. Из-за повторения информации она хуже подвержена селекции, а значит, может быстрее накапливать мутации и изменять организм.
Свойства гена
У каждого человека имеется огромная Гены - это функциональные единицы в ее структуре. Но даже такие малые участки имеют свои уникальные свойства, позволяющие сохранять стабильность органической жизни:
- Дискретность - способность генов не смешиваться.
- Стабильность - сохранение структуры и свойств.
- Лабильность - возможность изменяться под действием обстоятельств, подстраиваться под враждебные условия.
- Множественный аллелизм - существование внутри ДНК генов, которые, кодируя один и тот же белок, имеют разную структуру.
- Аллельность - наличие двух форм одного гена.
- Специфичность - один признак = один ген, передающийся по наследству.
- Плейотропия - множественность эффектов одного гена.
- Экспрессивность - степень выраженности признака, который кодируется данным геном.
- Пенетрантность - частота встречаемости гена в генотипе.
- Амплификация - появление значительного количества копий гена в ДНК.
Геном

Геном человека - это весь наследственный материал, который находится в единственной клетке человека. Именно в нем содержатся указания о построении тела, работе органов, физиологических изменениях. Второе определение данного термина отражает структуру понятия, а не функцию. Геном человека - это совокупность генетического материала, упакованного в гаплоидном наборе хромосом (23 пары) и относящегося к конкретному виду.
Основу генома составляет молекула хорошо известная как ДНК. Все геномы содержат по крайней мере два вида информации: кодированная информация о структуре молекул-посредников (так называемых РНК) и белка (эта информация содержится в генах), а также инструкции, которые определяют время и место проявления этой информации при развитии организма. Сами гены занимают небольшую часть генома, но при этом являются его основой. Информация, записанная в генах, — своего рода инструкция для изготовления белков, главных строительных кирпичиков нашего тела.
Однако для полной характеристики генома недостаточно заложенной в нем информации о структуре белков. Нужны еще данные об элементах которые принимают участие в работе генов, регулируют их проявление на разных этапах развития и в разных жизненных ситуациях.
Но даже и этого мало для полного определения генома. Ведь в нем присутствуют также элементы, способствующие его самовоспроизведению (репликации), компактной упаковке ДНК в ядре и еще какие-то непонятные пока еще участки, иногда называемые «эгоистичными» (то есть будто бы служащими только для самих себя). По всем этим причинам в настоящий момент, когда заходит речь о геноме, обычно имеют в виду всю совокупность последовательностей ДНК, представленных в хромосомах ядер клеток определенного вида организмов, включая, конечно, и гены.
Размер и структура генома

Логично предположить, что ген, геном, хромосома отличаются у разных представителей жизни на Земле. Они могут быть как бесконечно маленькими, так и огромными и вмещать в себе миллиарды пар генов. Структура гена также будет зависеть от того, чей геном вы исследуете.
По соотношению между размерами генома и числом входящих в него генов можно выделить два класса:
- Компактные геномы, имеющие не более десяти миллионов оснований. У них совокупность генов строго коррелирует с размером. Наиболее характерны для вирусов и прокариотов.
- Обширные геномы состоят более чем из 100 миллионов пар оснований, не имеющих взаимосвязи между их длиной и количеством генов. Чаще встречаются у эукариотов. Большинство нуклеотидных последовательностей в этом классе не кодируют белков или РНК.
Исследования показали, что в геноме человека находится около 28 тысяч генов. Они неравномерно распределены по хромосомам, но значение этого признака остается пока загадкой для ученых.
Хромосомы

Хромосомы - это способ упаковки генетического материала. Они находятся в ядре каждой эукариотической клетки и состоят из одной очень длинной молекулы ДНК. Их легко можно увидеть в световой микроскоп в процессе деления. Кариотипом называется полный набор хромосом, который является специфичным для каждого отдельного вида. Обязательными элементами для них являются центромера, теломеры и точки репликации.
Изменения хромосом в процессе деления клетки
Хромосома - это последовательные звенья цепи передачи информации, где каждое следующее включает предыдущее. Но и они претерпевают определенные изменения в процессе жизни клетки. Так, например, в интерфазе (период между делениями) хромосомы в ядре расположены рыхло, занимают много места.
Когда клетка готовится к митозу (т. е. к процессу разделения надвое), хроматин уплотняется и скручивается в хромосомы, и теперь его становится видно в световой микроскоп. В метафазе хромосомы напоминают палочки, близко расположенные друг к другу и соединенные первичной перетяжкой, или центромерой. Именно она отвечает за формирование веретена деления, когда группы хромосом выстраиваются в линию. В зависимости от размещения центромеры существует такая классификация хромосом:
- Акроцентрические - в этом случае центромера расположена полярно по отношению к центру хромосомы.
- Субметацентрические, когда плечи (то есть участки, находящиеся до и после центромеры) неравной длины.
- Метацентрические, если центромера разделяет хромосому ровно посередине.
Данная классификация хромосом была предложена в 1912 году и используется биологами вплоть до сегодняшнего дня.
Аномалии хромосом

Как и с другими морфологическими элементами живого организма, с хромосомами тоже могут происходить структурные изменения, которые влияют на их функции:
- Анеуплоидия. Это изменение общего числа хромосом в кариотипе за счет добавления или удаления одной из них. Последствия такой мутации могут быть летальными для еще не родившегося плода, а также приводить к врожденным дефектам.
- Полиплоидия. Проявляется в виде увеличения количества хромосом, кратного половине их числа. Чаще всего встречается у растений, например водорослей, и грибов.
- Хромосомные аберрации, или перестройки, - это изменения в строении хромосом под воздействием факторов внешней среды.
Генетика
Генетика - это наука, изучающая закономерности наследственности и изменчивости, а также обеспечивающие их биологические механизмы. В отличие от многих других биологических наук она с момента своего возникновения стремилась быть точной наукой. Вся история генетики — это история создания и использования все более и более точных методов и подходов. Идеи и методы генетики играют важную роль в медицине, сельском хозяйстве, генетической инженерии, микробиологической промышленности.
Наследственность - способность организма обеспечивать в ряду морфологических, биохимических и физиологических признаков и особенностей. В процессе наследования воспроизводятся основные видоспецифические, групповые (этнические, популяционные) и семейные черты строения и функционирования организмов, их онтогенеза (индивидуального развития). Наследуются не только определенные структурно-функциональные характеристики организма (черты лица, некоторые особенности обменных процессов, темперамента и др.), но и физико-химические особенности строения и функционирования основных биополимеров клетки. Изменчивость — разнообразие признаков среди представителей определенного вида, а также свойство потомков приобретать отличия от родительских форм. Изменчивость вместе с наследственностью представляют собой два неразделимых свойства живых организмов.
Синдром Дауна

Синдром Дауна - генетическое заболевание, при котором кариотип состоит из 47 хромосом у человека вместо обычных 46. Это одна из форм анеуплоидии, о которой говорилось выше. В двадцать первой паре хромосом появляется добавочная, которая привносит лишнюю генетическую информацию в геном человека.
Название свое синдром получил в честь врача, Дона Дауна, который открыл и описал его в литературе как форму психического расстройства в 1866 году. Но генетическая подоплека была обнаружена почти на сто лет позже.
Эпидемиология

На данный момент кариотип в 47 хромосом у человека встречается один раз на тысячу новорожденных (ранее статистика была иной). Это стало возможным благодаря ранней диагностике данной патологии. Заболевание не зависит от расы, этнической принадлежности матери или ее социального положения. Оказывает влияние возраст. Шансы родить ребенка с синдромом Дауна возрастают после тридцати пяти лет, а после сорока соотношение здоровых детей к больным равняется уже 20 к 1. Возраст отца старше сорока лет также увеличивает шансы на рождение ребенка с анеуплоидией.
Формы синдрома Дауна
Наиболее частый вариант - появление дополнительной хромосомы в двадцать первой паре по ненаследственному пути. Он обусловлен тем, что во время мейоза эта пара не расходится по веретену деления. У пяти процентов заболевших наблюдается мозаицизм (дополнительная хромосома содержится не во всех клетках организма). Вместе они составляют девяносто пять процентов от общего количества человек с этой врожденной патологией. В остальных пяти процентах случаев синдром вызван наследственной трисомией двадцать первой хромосомы. Однако рождение двух детей с этим заболеванием в одной семье незначительно.
Клиника
Человека с синдромом Дауна можно узнать по характерным внешним признакам, вот некоторые из них:
Уплощенное лицо;
- укороченный череп (поперечный размер больше продольного);
- кожная складка на шее;
- складка кожи, которая прикрывает внутренний угол глаза;
- чрезмерная подвижность суставов;
- сниженный тонус мышц;
- уплощение затылка;
- короткие конечности и пальцы;
- развитие катаракты у детей старше восьми лет;
- аномалии развития зубов и твердого неба;
- врожденные пороки сердца;
- возможно наличие эпилептического синдрома;
- лейкозы.
Но однозначно поставить диагноз, основываясь только на внешних проявлениях, конечно, нельзя. Необходимо провести кариотипирование.
Заключение
Ген, геном, хромосома - кажется, что это просто слова, значение которых мы понимаем обобщенно и весьма отдаленно. Но на самом деле они сильно влияют на нашу жизнь и, изменяясь, заставляют меняться и нас. Человек умеет подстраиваться под обстоятельства, какими бы они ни оказались, и даже для людей с генетическими аномалиями всегда найдется время и место, где они будут незаменимы.
Геном рыбы фугу примерно в восемь раз меньше, чем геном человека, и в 330 раз меньше, чем геном двоякодышащей рыбы протоптер. Какие «призраки» живут на «кладбищах геномов», и сколько мусора в нашей с вами ДНК?
Известный молекулярный биолог Дэвид Пенни из Центра молекулярной экологии и эволюции Аллена Вилсона в новозеландском Университете Массей как-то сказал: «Я бы весьма гордился работой в группе, которая разработала геном кишечной палочки. Однако я бы никогда не признался, что участвовал в проектировании генома человека. Ни в одном университете этот проект не смогли бы настолько испортить». Тема о количестве мусора в нашей ДНК - одна из самых «горячих» тем в научном сообществе. Вокруг этого вопроса среди ученых разгораются настоящие словесные баталии.
Немного молекулярной генетики
Напомним, что в основе передачи наследственной информации лежит двухцепочечная молекула ДНК. Она представляет собой полимер из четырех типов мономеров (нуклеотидов): аденина (A), тимина (T), цитозина (С) и гуанина (G) - и уложена в хромосомы. У человека 23 пары расположенных в ядре хромосом (22 пары неполовых и одна пара половых). Они и составляют основу нашего генома (еще 37 генов содержат кольцевые ДНК митохондрий). Если бы мы взяли одну клетку человека, сшили весь диплоидный (парный) набор хромосом вместе и вытянули в нить, то получили бы молекулу длиной в два метра, состоящую из шести миллиардов пар оснований (нуклеотидов). Три миллиарда от папы и три - от мамы.

Наиболее изученный тип функциональных последовательностей ДНК - гены, кодирующие белки. С таких генов считывается молекула РНК, которая затем играет роль матрицы для синтеза белков и определяет их аминокислотную последовательность. Кодирующая часть молекулы РНК может быть разделена на тройки нуклеотидов (кодоны), которые либо соответствуют некоторой аминокислоте, либо определяют место окончания синтеза белка (стоп-кодоны). Правило соответствия кодонов аминокислотам называется генетическим кодом. Например, кодон GCC кодирует аминокислоту аланин.
Померимся генами?
Когда-то думали, что у столь сложного организма, как человек, должно быть очень много генов. Когда проект «Геном человека» подходил к завершению, ученые даже устроили тотализатор: сколько генов будет обнаружено?
Каково же было их удивление, когда оказалось, что количество генов у человека и маленького круглого червя Caenorhabditis elegans примерно одинаковое. У червяка около 20 000 генов, а у нас - 20−25 тысяч.
Для «венца творения» факт довольно обидный, особенно если учесть, что существует много организмов как с бóльшим по размеру геномом (геном двоякодышащей рыбы протоптер, Protopterus aethiopicus , в 40 раз больше человеческого), так и с бóльшим количеством генов (у риса - 32−50 тысяч генов).
Но на самом деле у человека менее 2% генома кодируют какие-либо белки. Для чего же нужны остальные 98%? Может, там скрывается секрет нашей сложности? Оказалось, что существуют важные некодирующие участки ДНК. Например, это участки промоторов - последовательностей нуклеотидов, на которые садится фермент РНК-полимераза и откуда начинается синтез молекулы РНК. Это участки связывания транскрипционных факторов - белков, регулирующих работу генов. Это теломеры, защищающие концы хромосом, и центромеры, необходимые для правильного расхождения хромосом по разным полюсам клеток при делении. Известны некоторые регуляторные молекулы РНК (например, микроРНК, препятствующие синтезу белков соответствующих генов на матричной РНК - копии гена-исходника), а также молекулы РНК, входящие в состав важных ферментативных комплексов - например, рибосом, которые собирают из отдельных аминокислот белки, передвигаясь по матричной РНК. Есть и другие примеры важных некодирующих участков ДНК.
Тем не менее бóльшая часть нашего генома напоминает пустыню: повторяющиеся последовательности, останки «мертвых» вирусов, которые когда-то давно встраивались в геномы наших предков; так называемые эгоистичные мобильные элементы - последовательности ДНК, способные перескакивать из одного участка генома в другой; различные псевдогены - нуклеотидные последовательности, утратившие способность кодировать белки в результате мутаций, но все еще сохранившие некоторые признаки генов. Это далеко не полный список «призраков», обитающих на «кладбище генома».
Минимальная мышь
Существует точка зрения, что бóльшая часть генома человека нефункциональна. В 2004 году журнал Nature опубликовал статью, описывавшую мышей, из генома которых были вырезаны значительные фрагменты некодирующей ДНК размером в 0,8 и даже 1,5 млн нуклеотидов. Было показано, что эти мыши не отличаются от обычных строением тела, развитием, продолжительностью жизни или способностью оставлять потомство. Разумеется, какие-то отличия могли остаться незамеченными, но в целом это был серьезный аргумент в пользу существования «мусорной ДНК», от которой можно избавиться без особых последствий. Конечно, было бы интересно вырезать не пару миллионов нуклеотидов, а миллиард, оставив только предсказанные последовательности генов и известные функциональные элементы. Удастся ли вывести подобную «минимальную мышь», и сможет ли она нормально существовать? Может ли человек обойтись геномом длиной лишь в полметра? Возможно, когда-нибудь мы об этом узнаем. Тем временем еще один важный аргумент в пользу существования мусорной ДНК - наличие достаточно близких организмов с очень разными размерами геномов.
Геном рыбы фугу примерно в восемь раз меньше, чем геном человека (хотя генов в нем примерно столько же), и в 330 раз меньше, чем геном уже упомянутой рыбы протоптер. Если бы каждый нуклеотид в геноме был функционален, то непонятно, зачем луку геном в пять раз больший, чем у нас?
На колоссальные различия в размерах геномов сходных организмов обратил внимание эволюционный биолог Сусуму Оно. Считается, что именно Оно ввел термин «мусорная ДНК» (junk DNA). Еще в 1972 году, задолго до того, как был прочитан геном человека, Оно высказал правдоподобные представления как о количестве генов в геноме человека, так и о количестве «мусора» в нем. В своей статье «Столько мусорной ДНК в нашем геноме» он отмечает, что в геноме человека должно быть около 30 000 генов. Это число, на тот момент совсем не очевидное, оказалось удивительно близко к реальному, которое узнали десятки лет спустя. Кроме того, Оно приводит оценку функциональной доли генома (6%), объявляя более 90% генома человека мусором.
специалист по эволюционной биологии и интегративной геномике, адъюнкт-профессор канадского Университета Гэльфа в провинции Онтарио:«Луковый тест - хорошая проверка для любого, кто думает, что каждый нуклеотид в человеческом геноме имеет определенную функцию. Независимо от того, каковы эти предполагаемые функции, спросите себя: зачем обычному репчатому луку нужен геном примерно в пять раз больше вашего?»
Находка или мусор?
Вызов представлению о существовании мусорной ДНК бросил проект ENCODE - The Encyclopedia of DNA Elements, «Энциклопедия элементов ДНК» (первые его результаты опубликованы в журнале Nature в 2012 году). Получив многочисленные экспериментальные данные о том, какие части генома человека взаимодействуют с различными белками, участвуют в транскрипции - синтезе РНК-копий генов для последующей трансляции (синтеза белка из аминокислот на матрице информационной РНК) - или других биохимических процессах, авторы пришли к выводу, что более 80% генома человека так или иначе функциональны. Разумеется, данный тезис вызвал бурное обсуждение в научном сообществе.
Одна из наиболее ироничных статей, опубликованная Дэном Грауром, специалистом по молекулярной эволюционной биоинформатике, профессором Хьюстонского университета, и его коллегами в 2013 году в журнале Genome biology and evolution , называется так: «О бессмертии телевизоров: «функция» в геноме человека по лишенному эволюции Евангелию от ENCODE». Ее авторы отмечают, что отдельные члены консорциума ENCODE расходятся в том, какая часть генома функциональна. Так, один из них вскоре уточнил в журнале Genomicron , что речь идет не о 80% функциональных последовательностей в геноме, а о 40%, а другой (в статье в Scientific American ) и вовсе снизил показатель до 20%, но при этом продолжал настаивать, что термин «мусорная ДНК» нужно устранить из лексикона.
По мнению авторов статьи «О бессмертии телевизоров», члены консорциума ENCODE слишком вольно интерпретируют термин «функция». Например, существуют белки, которые называют гистонами. Они могут связывать молекулу ДНК и помогают ей компактно укладываться. Гистоны могут подвергаться определенным химическим модификациям. Согласно ENCODE, предположительная функция одной из таких модификаций гистонов - «предпочтение находиться в 5"-конце генов» (5"-конец - это конец гена, от которого движутся ферменты ДНК- и РНК-полимеразы при копировании ДНК или при транскрипции). «Примерно так же можно сказать, что функция Белого дома - занимать площадь земли по адресу 1600, Пенсильвания-авеню, Вашингтон, округ Колумбия», - отмечают оппоненты.
Возникает проблема и с приписыванием функции участкам ДНК. Предположим, что к определенному участку ДНК способен прикрепляться важный для функционирования клетки белок, и поэтому ENCODE приписывает этому участку «функцию». Например, некоторый транскрипционный фактор - белок, инициирующий синтез информационной (матричной) РНК - связывается со следующей последовательностью нуклеотидов: TATAAA. Рассмотрим две идентичные последовательности TATAAA в разных частях генома. После того как транскрипционный фактор связывается с первой последовательностью, начинается синтез молекулы РНК, служащей матрицей для синтеза другого важного белка. Мутации (замены любого из нуклеотидов) в этой последовательности приведут к тому, что РНК будет считываться плохо, белок не будет синтезирован, и это, скорее всего, негативно скажется на выживании организма. Поэтому правильная последовательность TATAAA будет поддерживаться в данном месте генома с помощью естественного отбора, и в этом случае уместно говорить о наличии у нее функции.
Другая последовательность TATAAA возникла в геноме по случайным причинам. Поскольку она идентична первой, с ней тоже связывается транскрипционный фактор. Но никакого гена рядом нет, поэтому связывание ни к чему не приводит. Если в этом участке возникнет мутация, ничего не изменится, организм не пострадает. В данном случае говорить о функции второго участка TATAAA нет смысла. Впрочем, может оказаться, что наличие в геноме большого количества последовательностей TATAAA вдали от генов нужно просто для того, чтобы связывать транскрипционный фактор и уменьшать его эффективную концентрацию. В таком случае отбор будет регулировать число таких последовательностей в геноме.
Чтобы доказать, что некоторый участок ДНК функционален, недостаточно показать, что в этом участке происходит некий биологический процесс (например, связывание ДНК). Члены консорциума ENCODE пишут, что функцией обладают участки ДНК, которые вовлечены в транскрипцию. «Но почему нужно акцентировать внимание на том, что 74,7% генома транскрибируется, в то время как можно сказать, что 100% генома принимает участие в воспроизводимом биохимическом процессе - репликации!», - снова шутит Граур.
Репликация
Репликация (от лат. replicatio - возобновление) - процесс синтеза дочерней молекулы дезоксирибонуклеиновой кислоты на матрице родительской. При следующем за этим делении каждая из дочерних клеток получает по одной копии молекулы ДНК, идентичной ДНК исходной материнской клетки. Репликацию ДНК осуществляет реплисома - сложный ферментный комплекс, состоящий из 15−20 различных белков.
Хорошим критерием функциональности участка ДНК является то, что мутации в нем достаточно вредны и значительные изменения этого участка не наблюдаются из поколения в поколение. Как определить такие участки? Здесь на помощь и приходит биоинформатика, современная наука на стыке биологии и математики об анализе последовательностей генов и белков. Мы можем взять геномы человека и мыши и найти в них все похожие участки ДНК. Окажется, что у этих двух видов какие-то участки последовательностей нуклеотидов очень похожи. Например, гены, необходимые для синтеза рибосомальных белков, довольно консервативны, то есть мутации в них достаточно вредны, чтобы носители новых мутаций вымирали, не оставляя потомства. Про такие гены говорят, что они находятся под отрицательным отбором, очищающим от вредных мутаций. Другие участки геномов будут иметь значительные расхождения между видами, что указывает на то, что мутации в этих участках, скорее всего, безвредны, а значит, их функциональная роль невелика или не определяется конкретной последовательностью нуклеотидов. В ряде работ оценили долю участков ДНК человека, находящихся под давлением отрицательного отбора. Оказалось, что к ним относятся только около 6,5−10% генома, причем некодирующие участки, в отличие от кодирующих, гораздо меньше подвержены отрицательному отбору. Получается, что с точки зрения эволюционных критериев функциональны менее 10% генома человека. Обратите внимание, как близок к этой оценке был Оно в 1972 году!
Мусорная крепость


Но неужели остальные 90% генома человека - мусор, от которого лучше избавиться? Не совсем так. Есть соображения, что большой размер генома может быть полезен сам по себе. У бактерий репликация генома служит серьезным ограничивающим фактором, требующим значительных затрат энергии. Поэтому их геномы, как правило, маленькие, а от всего лишнего они избавляются. У крупных организмов, как правило, репликация ДНК делящихся клеток вносит не столь большой вклад в общее количество энергозатрат организма на фоне расходов на работу мозга, мышц, органов выделения, поддержания температуры тела и т. д. В то же время большой геном может быть важным источником генетического разнообразия, увеличивая шансы на появление новых функциональных участков из нефункциональных за счет мутаций, потенциально полезных в процессе эволюции. Мобильные элементы могут переносить регуляторные элементы, создавая генетическое разнообразие в регуляции работы генов. То есть организмы с крупными геномами теоретически могут быстрее адаптироваться к условиям среды, расплачиваясь сравнительно небольшими дополнительными затратами на репликацию более крупного генома. Подобный эффект мы не обнаружим у отдельного организма, но он может играть важную роль на уровне популяции.
Наличие крупного генома может также уменьшать вероятность того, что какой-нибудь вирус встроится в функциональный ген (что может привести к поломке гена и в ряде случаев к раку). Иными словами, не исключено, что естественный отбор может действовать не только на поддержание конкретных последовательностей в геноме, но на сохранение определенных размеров генома, нуклеотидного состава в некоторых его участках и т. д.
Впрочем, хотя идея, что только 80% или даже 20% генома человека функциональны - спорна, это вовсе не значит, что критике подлежит весь проект ENCODE. В его рамках получено огромное количество данных о том, как разные белки связываются с ДНК, информации о регуляции генов и т. д. Эти данные представляют большой интерес для специалистов. Но едва ли в ближайшее время удастся избавиться от «мусора» в геноме - как от концепции, так и от самих ненужных последовательностей.
Введение ………………………………………………………………………...3
1. Сколько генов в человеческом организме?………………………...……… 5
2. Проект "Геном человека"…………. ……………………………………...…7
3. Результаты проекта "Геном человека"………………………………….….12
Заключение …………………………………………………………………….18
Список литературы………………………………………………………..….. 19
Введение
"...Но прежде прибери в комнатах, вымой окна, натри пол, выбели кухню, выполи грядки, посади под окнами семь розовых кустов, разбери семь мешков фасоли: белую отбери от коричневой, познай саму себя…"
Е.Л. Шварц. "Золушка"
Наверное, самым трудным для Золушки в заданиях злой и коварной мачехи было: «Познай саму себя!» Все остальное трудно, но понятно - действия привычные, выдумывать ничего не надо, только поспевай... А что значит: «Познай саму себя»? Узнать, как ты движешься, думаешь или дышишь, когда перебираешь фасоль? А может быть, первый шаг к настоящему пониманию человека - узнать, как он воспроизводит себе подобных?
Когда несколько американских ученых в 1986-1987 годах принялись неслыханно дерзко уговаривать руководителей Министерства энергетики США выделить несколько миллиардов долларов на фантастический проект: узнать строение всех генов человека - это был правильный шаг к познанию самих себя. Узнав строение генов, можно было посягнуть и на то, чтобы вторгнуться реально в понимание процессов мышления и реагирования на стимулы, приходящие из окружающей среды и т.д. Как только проект, названный «Геном человека», был объявлен, начались новые муки: множество людей во всем мире, причем не просто обыватели, а профессора и руководители институтов, стали его резко критиковать, называя его «завиральным», нереальным и попросту глупым. Вложенных средств он не оправдает, усилий потребует столько, что все ученые, забросив остальные дела, справиться с ним не смогут и т. п. Деньги затея поглотит, а толку все равно не будет. Рановато еще к этому приступать, твердили эти знатоки, наука не созрела для решения таких задач, технических возможностей не создано, лучше прекратить с самого начала нелепую выдумку, а деньги пустить на действительно реальные проекты.
Если бы на этом настаивали специалисты по ядерной физике или физической химии, было бы понятно, ведь из-за «Генома человека» приостановили другие дорогие проекты, прежде всего в области физики. Но в хоре протестов выделялись и голоса биологов, особенно из Западной Европы и СССР. Правда, в СССР были и другие ученые, в частности, академик А.А. Баев, которые сразу же постарались включиться в международный проект и извлечь из него максимальную пользу.
Когда проект только начинал свою работу, казалось, что для его завершения понадобится не менее 20 лет. Однако уже в 2000 г. усилиями ученых всего мира геном человека был прочитан. Его можно сравнить с книгой, которая содержит в себе последовательность знаков в 800 раз длиннее, чем Библия, однако смысл большинства «предложений» в тексте книги нам еще непонятен, и его предстоит расшифровывать еще долгие годы. Чем больше текста нашего генома удастся разгадать, тем больше появится возможностей для профилактики и лечения наследственных заболеваний, в том числе и таких, которые затрагивают психическую сферу человека.
Сколько генов в человеческом организме?
Молекулярную основу генома человека составляет молекула ДНК - знаменитая «нить жизни», двуспиральная модель структуры, которой была гениально предсказана и обоснована в работе нобелевских лауреатов Джеймса Уотсона и Фрэнсиса Крика еще в 1953 году. Спираль состоит из 4-х пар оснований (нуклеотидов); двух пуринов (аденин, гуанин) и двух пиримидинов (тимин и цитозин), соединенных между собой через дезоксирибозу и остатки фосфорной кислоты в длинную нить. Две нити соединяются между собой посредством водородных связей своих нуклеотидов, причем так, что аденин всегда соединен с тимином, а гуанин - с цитозином. В дальнейшем оказалось, что именно в чередовании пар оснований в ДНК и заложен генетический код для каждой из 20 аминокислот, причем этот код оказался трехбуквенным, то есть каждой аминокислоте соответствует свои три нуклеотида, свой триплет. Было так же установлено, что в каждой клетке человека длина молекулы ДНК около 1,5–2 м, а число нуклеотидов, составляющих эту уникальную «нить жизни» достигает 3.3 миллиарда. Фрагменты этой нити и составляют то, что называется генами, то есть кодирующими участками генома, определяющими структуру всех белков организма. Естественно, поэтому точное данные о структуре генома человеке, т.е. о первичной последовательности его нуклеотидов, равно как и данные обо всех генах человека давно привлекали и привлекают самое пристальное внимание ученых-биологов.
Как представить себе 3 млрд. оснований зримо? Чтобы воспроизвести информацию, содержащуюся в ДНК единственной клетки, даже самым мелким шрифтом (как в телефонных справочниках), понадобится тысяча 1000-страничных книг! Сколько же всего генов, то есть последовательностей нуклеотидов, кодирующих белки, в ДНК человека? Года три назад полагали, что около 100 тыс. , затем решили, что не более 80 тыс. В конце 1998 г. пришли к выводу, что в геноме человека 50–60 тыс. генов. На их долю приходится только 3% общей длины ДНК. Роль остальных 97% пока не ясна.
Проект «Геном человека»
Белки выполняют в организме самые различные функции. В качестве ферментов они служат катализаторами химических реакций; в роли гормонов они, наряду с нервной системой, управляют работой различных органов, передавая химические сигналы. Белки используются в организме и как строительный материал (например, в мышечной ткани), и как транспортные средства (гемоглобин крови переносит кислород).
Размах синтеза белка, происходящего в клетке, огромен. Геном человека (набор последовательностей ДНК, определяющих генетическую индивидуальность человека) содержит порядка 6 биллионов нуклеотидов, из которых сформировано примерно 100 000 генов, чьи Размеры варьируют в пределах от 1000 до 2 миллионов нуклеотидных пар.
Описание всех генов человека и расшифровка соответствующих последовательностей ДНК - основная задача международного исследовательского проекта «Геном Человека», который является самым крупным генетическим проектом в мире. Благодаря усилиям многих генетических лабораторий мира ученые будут иметь в своем распоряжении полное описание генома человека.
Цель проекта - выяснить последовательности азотистых оснований и положения генов (картирование) в каждой молекуле ДНК каждой клетки человека, что открыло бы причины наследственных заболеваний и пути к их лечению. В проекте заняты тысячи специалистов со всего мира: биологов, химиков, математиков, физиков и техников. Это один из самых дорогих научных проектов в истории. В 1990 г. на него потрачено 60 млн. долл., в 1991 г. - 135 млн., в 1992-1995 гг. - от 165 до 187 млн. в год, а в 1996-1998 гг. только США израсходовали 200, 225 и 253 млн.
Интерес к уже полученным результатам огромен: самые цитируемые в 1998 г. авторы (не только в генетике или биологии, но во всех областях науки) Марк Адамс и Крэйг Вентер из Института исследований генома в штате Мэриленд (США) - частной компании, занимающейся только составлением "генных карт".
Вехи проекта
Проект состоит из пяти основных этапов:
1. Составление карты, на которой помечены гены, отстоящие друг от друга не более, чем на 2 млн. оснований, на языке специалистов, с разрешением 2 Мб (Мегабаза - от английского слова "base" - основание);
2. Завершение физических карт каждой хромосомы с разрешением 0,1 Мб;
3. Получение карты всего генома в виде набора описанных по отдельности клонов (0,005 Мб);
4.К 2004 г. полное секвенирование ДНК (разрешение 1 основание);
5. Нанесение на карту с разрешением в 1 гб основание всех генов человека (к 2005 г.). Когда эти этапы будут завершены, исследователи определят все функции генов, а также биологические и медицинские применения результатов.
Три карты
В ходе проекта создают три типа карт хромосом: генетические, физические и секвенсовые (от англ. sequence - последовательность). Выявить все гены, присутствующие в геноме, и установить расстояния между ними - значит локализовать каждый ген в хромосомах. Такие генетические карты помимо инвентаризации генов и указания их положений ответят на исключительно важный вопрос о том, как гены определяют те или иные признаки организма. Ведь многие признаки зависят от нескольких генов, часто расположенных в разных хромосомах, и знание положения каждого из них позволит понять, как происходит дифференцировка (специализация) клеток, органов и тканей, а также успешнее лечить генетические заболевания. В 20-е и 30-е годы, когда создавалась хромосомная теория наследственности, выяснение положения каждого гена привело к тому, что на генетических картах сначала дрозофилы, а затем кукурузы и ряда других видов удалось отметить особые точки, как тогда говорили, "генетические маркеры" хромосом. Анализ их положения в хромосомах помог снабдить генетические карты хромосом человека новыми сведениями. Первые данные о положении отдельных генов появились еще в 60-е годы. С тех пор они множились лавинообразно, и в настоящее время известно положение уже десятков тысяч генов. Три года назад разрешение генетической карты составляло 10 Мб (для некоторых участков - даже 5 Мб).
Другое направление исследований - составление физических карт хромосом. Еще в 60-е годы цитогенетики стали окрашивать хромосомы, чтобы выявить на них особые поперечные полосы. После окрашивания полосы было видно в микроскоп. Между полосами и генами удалось установить соответствие, что позволило изучать хромосомы по-новому. Позже научились "метить" молекулы ДНК (радиоактивными или флуоресцентными метками) и следить за присоединением этих меток к хромосомам, что значительно повысило разрешение их структуры: до 2 Мб, а потом и до 0,1 Мб (при делении клеток). В 70-е годы научились "разрезать" ДНК на участки специальными «рестрикционными» ферментами, распознающими короткие отрезки ДНК, в которых информация записана в виде палиндромов - сочетаний, читаемых одинаково от начала к концу и от конца к началу. Так возникли «рестрикционные» карты хромосом. Использование современных физических и химических методов и средств улучшило разрешение физических карт в сотни раз.
Наконец, разработка методов секвенирования (изучения точных последовательностей нуклеотидов в ДНК) открыла путь к созданию секвенсовых карт с рекордным на сегодня разрешением (на этих картах будет указано положение всех нуклеотидов в ДНК).
Два подхода
Число хромосом и их длина различны у разных биологических видов. В клетках бактерий всего одна хромосома. Так, размер генома бактерии Mycoplasma genitalium 0,58 Мб (в нем 470 генов), у бактерии кишечной палочки (Escherichia coli) в геноме 4200 генов (4,2 Мб), у растения Arabi dopsis thaliana - 25 тыс. генов (100 Мб), у плодовой мушки Drosophila melanogaster - 10 тыс. генов (120 Мб). В ДНК мыши и человека 50-60 тыс. генов (3000 Мб). Конечно, для составления карт столь разных объектов одни и те же методы неприменимы, поэтому используют два разных по методологии подхода. В первом делят ДНК на небольшие куски и, изучив их по отдельности, воссоздают всю структуру, Этот подход увенчался успехом при составлении сравнительно простых карт. Для более сложных геномов эффективнее второй подход. В этих случаях неразумно делить молекулу ДНК на короткие куски, удобные для детального изучения. Их оказалось бы так много, что путаница в последовательностях была бы неразрешимой. Поэтому, принимаясь за расшифровку, молекулу делят, наоборот, на как можно более длинные куски и сравнивают их в надежде найти общие концевые участки. Если это удается, куски объединяют, после чего процедуру повторяют. С совершенствованием компьютеров и математических методов обработки информации объединенные по такому принципу куски становятся все крупнее, постепенно приближаясь к целой молекуле. Этот подход, в частности, позволил составить генетическую карту 3-й хромосомы дрозофилы.
Кладезь новых технологий
Важный аспект проекта «Геном человека» - разработка новых методов исследований. Еще до старта проекта был развит ряд весьма эффективных методов цитогенетических исследований (теперь их называют методами первого поколения). Среди них: создание и применение упомянутых рестрикционных ферментов. Получение гибридных молекул, их клонирование и перенос участков ДНК с помощью векторов в клетки-доноры (чаще всего - кишечной палочки или дрожжей). Синтез ДНК на матрицах информационной РНК. Секвенирование генов. Копирование генов с помощью специальных устройств. Способы анализа и классификации молекул ДНК по плотности, массе, структуре.
В последние 4-5 лет благодаря проекту "Геном человека" разработаны новые методы (методы второго поколения), в которых почти все процессы полностью автоматизированы. Почему это направление стало центральным? Самая маленькая хромосома клеток человека содержит ДНК длиной 50 Мб, самая большая (хромосома 1) - 250 Мб. До 1996 г. наибольший участок ДНК, выделяемый из хромосом с помощью реактивов, имел длину 0,35 Мб, а на лучшем оборудовании их структура расшифровывалась со скоростью 0,05-0,1 Мб в год при стоимости 1-2 долл. за основание. Иными словами, только на эту работу понадобилось бы примерно 30 тыс. дней (почти век) и 3 млрд. долларов.
Совершенствование технологии к 1998 г. повысило производительность до 0,1 Мб в день (36,5 Мб в год) и понизило стоимость до 0,5 долл. за основание. Использование новых электромеханических устройств, которые к тому же потребляют меньше реактивов, позволит уже в 1999 г. ускорить работы еще в 5 раз (к 2003 г. планируется довести скорость расшифровки до 500 Мб в год) и уменьшить стоимость до 0,25 долл. за основание (для человеческой ДНК еще дешевле).